MDCG 2022-1: Hinweis für Hersteller von SARS-CoV-2-In-vitro-Diagnostika in Drittländern
Die MDCG hat einen neuen Leitfaden veröffentlicht, der diesmal IVD-Hersteller aus Drittländern betrifft, die ihre SARS-CoV-2-Tests auf dem EU-Markt in Verkehr bringen wollen.
Wir haben die wichtigsten Fakten für Sie in dem folgenden Flussdiagramm zusammengefasst.
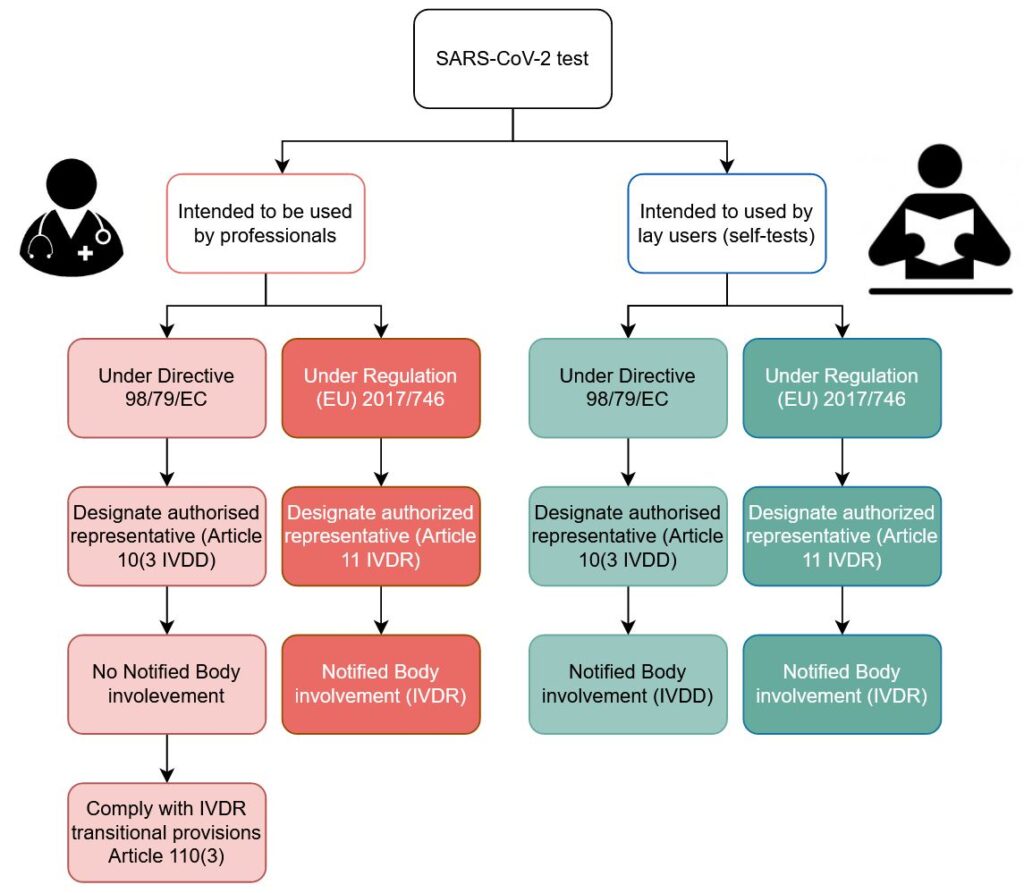
Vergessen Sie nicht die Kennzeichnung: Sie müssen für eine gute Qualität der Übersetzungen Ihrer Gebrauchsanweisung und des Etiketts in alle Amtssprachen sorgen, die in den Mitgliedstaaten vorgeschrieben sind, in denen Sie das Produkt zur Verfügung stellen. Insbesondere dort, wo das Produkt den Endverbraucher erreicht.
Wenn Sie eine benannte Stelle für Ihre IVDR-regulierten Tests benötigen, sollten Sie sich beeilen! Wie bereits erwähnt, wurden bisher nur sechs Benannte Stellen für die IVDR benannt. Da die Zahl der Produkte, die eine Beteiligung der Benannten Stelle erfordern, drastisch gestiegen ist, stellen die Prüfungen durch die Benannten Stellen einen Engpass für die IVD-Gemeinschaft dar.
